Se ti occupi di R&D o lavori in ambito regolatorio potresti avere la necessità di valutare la sicurezza dei tuoi prodotti o ingredienti in termini di genotossicità. I test di genotossicità costituiscono la base scientifica per la valutazione del rischio in diversi campi che spaziano dalla cosmesi all’industria farmaceutica (sostanze ad uso farmaceutico e impurità, dispositivi medici), il settore alimentare (additivi e packaging), il settore dei prodotti biocidi e altri ancora.
Le agenzie regolatorie internazionali hanno formulato varie raccomandazioni sulle strategie di testing e la maggior parte raccomanda l’uso di una combinazione di test, sia in vitro che in vivo. I test da presentare alle agenzie regolatorie generalmente devono essere condotti in conformità ai principi delle Buone pratiche di Laboratorio (BPL).
Tra i test in vitro il test di Ames è il saggio più ampiamente utilizzato ed è raccomandato dalle varie agenzie regolatorie. Il test prevede l’utilizzo di batteri per identificare composti mutageni e ha un alto valore predittivo in merito al potenziale cancerogeno relativamente ai test sugli animali.
Risulta inoltre particolarmente vantaggioso per la rapidità di ottenimento dei risultati e i costi relativamente contenuti rispetto ad altri test.
Abich-Lifeanalytics esegue il test di Ames secondo metodo OECD 471 ed è Centro di Saggio per gli studi di mutagenesi, certificato dal Ministero della Salute per l’esecuzione di prove in conformità ai principi delle Buone Pratiche di Laboratorio (BPL).
PRINCIPIO DEL TEST
Ceppi mutanti del batterio Salmonella typhimurium vengono esposti alla sostanza in esame. I ceppi coprono diverse tipologie di mutazioni e si caratterizzano per l’auxotrofia per un amminoacido. In altre parole tutti i ceppi hanno in comune l’incapacità di crescere in terreno minimo privo di istidina (triptofano nel caso di utilizzo di Escherichia coli in alternativa ad uno dei ceppi). In questo sistema il potenziale mutageno della sostanza viene misurato come reversione dal fenotipo auxotrofo (istidina-dipendente) a quello prototrofo (istidina-indipendente). L’esposizione alla sostanza viene effettuata anche in presenza di un sistema di attivazione metabolica da omogenato di fegato di roditori per la rilevazione di potenziali pro-mutageni. Il potenziale mutageno viene misurato come aumento del numero di colonie revertenti capaci di crescere in assenza dell’amminoacido istidina nel terreno di coltura agarizzato.
L’utilizzo di adeguati controlli positivi e negativi e l’analisi statistica dei risultati consente di determinare incrementi significativi rispetto al tasso di reversione spontanea e di rilevare eventuali effetti dose-correlati. Incrementi nel numero di colonie revertenti, anche in una sola delle condizioni sperimentali testate, evidenziano un potenziale mutageno della sostanza in esame. È anche possibile apportare variazioni al protocollo standard, utili ad esempio per effettuare screening di composti in fase R&D.
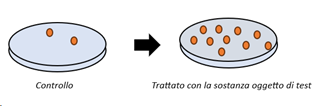
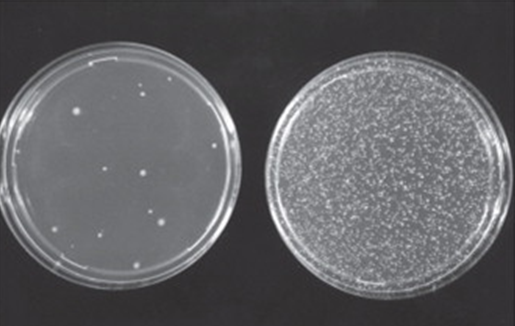
Immagine fotografica tratta da W. Föllmann et a.l in Brenner’s Encyclopedia of Genetics (Second Edition), 2013
✅ Stai sviluppando un nuovo prodotto o una materia prima innovativa e devi valutarne il potenziale mutageno ai fini della sicurezza?
✅ Noi siamo pronti per consigliarti l’approccio migliore per le tue necessità e fornirti tutte le informazioni che ti servono per testare la tua sostanza a garanzia della sicurezza!
? Contattaci per scoprire di più! Scrivici a